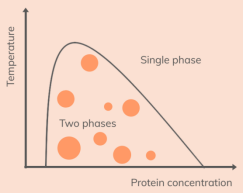
液-液相分离(Liquid-liquid phase separation,LLPS)是指大分子(如蛋白质、核酸等)在溶液中,凝聚浓缩成液滴状(droplet)从而形成密相,发生相分离,并与轻相共存的现象称为LLPS。LLPS是生命体的关键进程,在细胞中,相分离是分子间(蛋白质、RNA等)由弱相互作用的聚在一起形成大小不一的、独立的液滴,在显微镜下呈现出“油滴”状。并将其与周围的环境“隔离”,形成droplet,方便了分子之间快速地进行化学反应。]他们可以从液体逐渐转变为固体,形成无膜细胞器,如核仁、应激颗粒、中心体等[2];也可以随着环境的改变,从液滴状恢复成游离状态。正常状态下,大多数LLPS是可逆的,其形成条件取决于大分子浓度、分子特性、温度、pH值、共溶质等。如图A,在低浓度下,无论条件如何改变,LLPS都不会发生;随着大分子浓度的增加,溶液可能进入两相状态,改变温度、pH等条件时,两相转变可能发生[1]。
有研究表明LLPS失调与ALS[3][4][5][6]、白内障[7][8]、神经退行性疾病[9][10][11]等相关。例如,在健康人体内,当运动神经元受到温度、化学物质和其他环境因素的压力时,会形成液滴状的应激颗粒,可以随着环境的变化而消失。然而,在ALS 患者中,这种颗粒呈固体状,不会随着环境的改变消失。这提示这我们,通过干扰异常的LLPS使其恢复正常,或许可以为治疗这些疾病提供新的思路。
LLPS通常在体外进行研究,常用的表征方法有荧光显微法、浊度法及微流控技术、FRAP等。这些方法在研究体外LLPS时,或多或少都存在着一些限制性和挑战。以FRAP为例:FRAP利用激光将将样本漂白,然后在该区域恢复时检测该区域的荧光,如果相分离的droplet是液体状的,则荧光回收率很快;若相分离的droplet凝胶状液滴中的荧光恢复缓慢,光漂白后蛋白聚集物中的荧光信号无法恢复,根据不同组分的恢复时间差异来评估droplet的流动性。然而FRAP的恢复时间与液滴的稀释度、光漂白的液滴大小、内部流动性、光漂白区域的大小等,导致其在LLPS的研究中有一定的限制性,同时它不能作为确定某一结构形成LLPS的依据。
FIDA在LLPS表征上的应用
丹麦技术大学联合Fidabio公司提出了一种全自动高通量的方法-Capflex,这种方法仅需一台FIDA 1仪器即可完成,一次可测96个样品。通过检测荧光强度(内源荧光、YEP和Alexa488等),能够直接表征轻相中的分子浓度、droplet的size分布、形成动力学(何种条件下发生分离),以及产生LLPS时相关分子间的结合亲力。
–表征轻相浓度
样品检测前,利用FIDA 1的控温系统将样品温度控制在浊点之上,防止LLPS发生。样品进入毛细管(内径75μm,长度1m)后,控制温度在浊点之下,将样品溶液充满毛细管(3500mbar,40s),随后溶液以200mar的压力压入毛细管,540s。当液体经过探测器时,记录荧光信号值,droplet经过检测器会产生峰值(Signal spike),而轻相经过检测器时,记录的荧光信号值低,形成荧光信号值的basline。Basline越低,表明轻相浓度越低,LLPS程度越高。
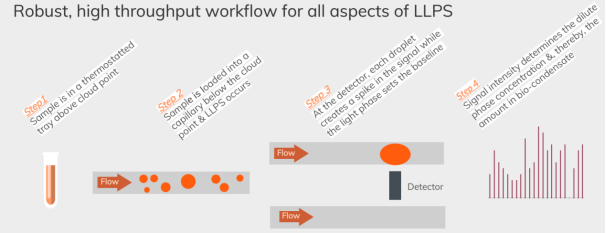
pH、配体等),确定从一个阶段到另一个阶段的过渡点,为LLPS的相分离提供可靠的判断性依据例如,可以利用Capflex在固定温度、pH等条件下,通过设置检测样品的浓度梯度,可以检测到样品发生LLPS的关键浓度以及在不同浓度下,样品LLPS的程度
表征Droplet大小分布和形成动力学
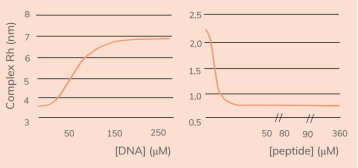
Droplet尺寸与峰值信号强度有关,因此峰值信号强度可以用来确定droplet的大小分布及中位数。Ddx4是nuage和germ granules的主要成分[12],其n1结构域 (Ddx4n1)被证明发生LLPS时是可逆的[13][14],是研究LLPS很好的蛋白质模型。Ddx4能够partition 单链DNA(ssDNA),利用Capflex研究DNA对LLPS的影响,发现在ssDNA的作用下,Ddx4n1的droplet大小分布的中位数和广度随ssDNA浓度的增大而减小,表明ssDNA会减少droplet的形成。
PEG在本实验中作为molecular crowder能够诱导LLPS发生。随着PEG3000浓度的增加,同一反应条件下对Ddx4n1形成LLPS的驱动力增大,平均峰强增加得更快,在1.5 min后达到最大峰值。
-表征配体对LLPS的影响
Fida 1具有内置的结合亲力测量功能,能够研究配体对LLPS的影响。
本实验测定了ssDNA与Ddx4n1和合成RP3肽(被用作为无膜细胞器模型,能与ssDNA形成凝聚)的结合亲力。结果凸显出了ssDNA分别与Ddx4n1和RP3之间相互作用强度的差异。与Ddx4n1不同,随着PR3浓度的增加,ssDNA水动力半径逐渐减小,表明DNA结构发生了强烈的崩溃,显示了RP3肽对负电荷DNA的强烈中和作用。
总结
Capflex是一种新的、全自动表征LLPS的新方法。只需要一台FIDA 1仪器,通过检测荧光强度,就能够判断相分离、测量轻相浓度、droplet大小分布、droplet形成动力学,这是其他荧光检测方法难以实现的。同时FIDA 1可以测量分子的水动力半径,从而计算LLPS下分子间的结合亲力,因此Capflex可应用于生物学相关的蛋白质和肽模型系统,这对LLPS的研究、LLPS失调而引发的疾病及其治疗靶点具有重要价值。
