“如果你从化学的角度看待生物学,你就无法否认,生物学在分子水平上做的几乎每一件复杂的事,都是借由序列特异的、折叠的杂聚物来实现的。”
– Sam Gellman,Uv. of Wisconsin-Madison
1987年,诺贝尔化学奖获得者,法国科学家J. M. Lehn 首次提出了“超分子化学”这一概念, 他指出: “基于共价键存在着分子化学领域, 基于分子组装体和分子间键而存在着超分子化学” 。
可以“自组装”的分子
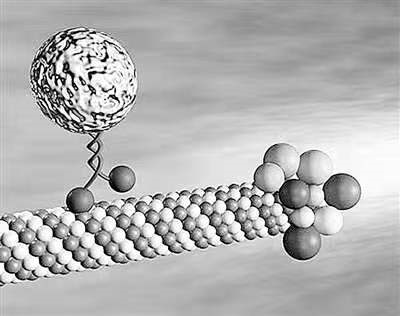
Samuel I. Stupp教授是Northwestern University化学/材料/医学 三个系的教授,是超分子化学领域的领军人物之一。2001年他在Science上发表了一篇题为“Self-Assembly and Mineralization of Peptide-Amphiphile Nanofibers”的研究报告,在这篇文章中,他们设计了一种可以自组装成纳米线的“两亲性”的短肽,可以诱导羟磷灰石在沿着其表面结晶,而羟磷灰石是骨骼的主要成分,该材料有潜在的修复骨骼的应用。那么什么是“两亲性”(Amphiphile)?分子如何“自组装”( self-assemble)?为什么会形成“胶束”(micelle)和“纳米线”( Nanofibers)?又怎么能诱导羟磷灰石结晶呢?(1)
大家最熟悉的两亲性分子应该是组成细胞膜的磷脂了(见下图),极性的头部是亲水性的,带着两个非极性的尾巴是疏水的,在水溶液中疏水的尾巴会尽量避免和水接触于是就组成了双分子层让亲水的基团朝外,这种为了降低能量自发排列成有序结构的现象就叫做“自组装”。
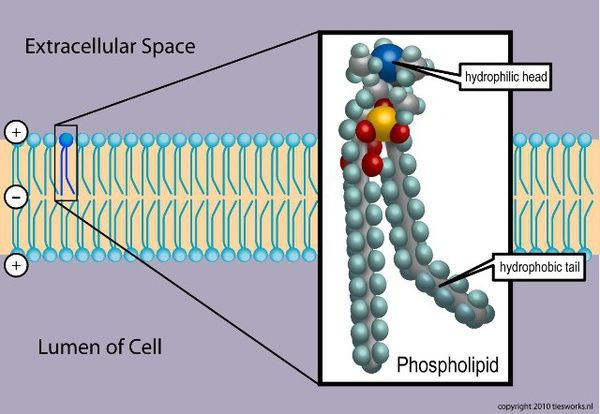
如果将两亲性分子形状简化为椎体模型,那么同种分子自组装形成的结构按“头”和“尾”的相对大小决定, 比如磷脂双分子层中头和尾巴差不多大就形成了膜状结构,当小于头的时候容易形成球状的胶束,而当头尾比略大的时候就容易形成柱状的胶束,也就是这篇文章中的纳米线了。
在Stupp的这篇文章里他们设计了这样一个分子,它有一条非极性的疏水尾巴1和极性的亲水基团2-5构成,中间有一段可以通过氧化形成二硫键让分子交联的半胱氨酸2,一段相对柔性的丙氨酸连接片段3,可以诱导钙离子结晶的磷酸根4,识别细胞的片段5。由于头比尾巴大,最终形成了纳米线的结构。而这个纳米线表面有大量的可以和细胞附着的片段和诱导钙离子结晶的磷酸根,最终实现了诱导钙在细胞表面沉积的目的(见下图)。
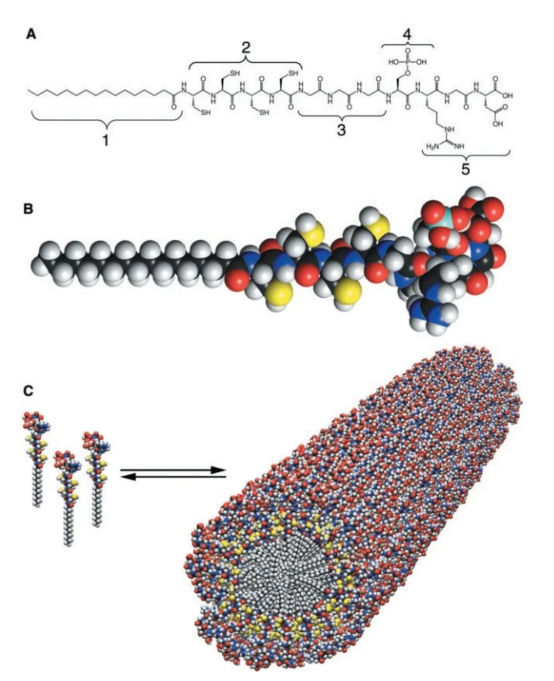
Stupp发展的这一套两亲性的短肽是提供了一种可调性非常多的Supramolecular scaffold, 只需更换上面分子中的区域4和5为其他功能性基团就能将这种纳米线的表面性质替换为其他功能。
“纳米药物”
发轫自上述的开创性工作,超分子在诸如新材料,高分子化学,再生医学材料等很多领域热度不减,方兴未艾。在治疗药物领域国内外也涌现出大量成果,并已有不少应用已经转化到临床试验阶段。
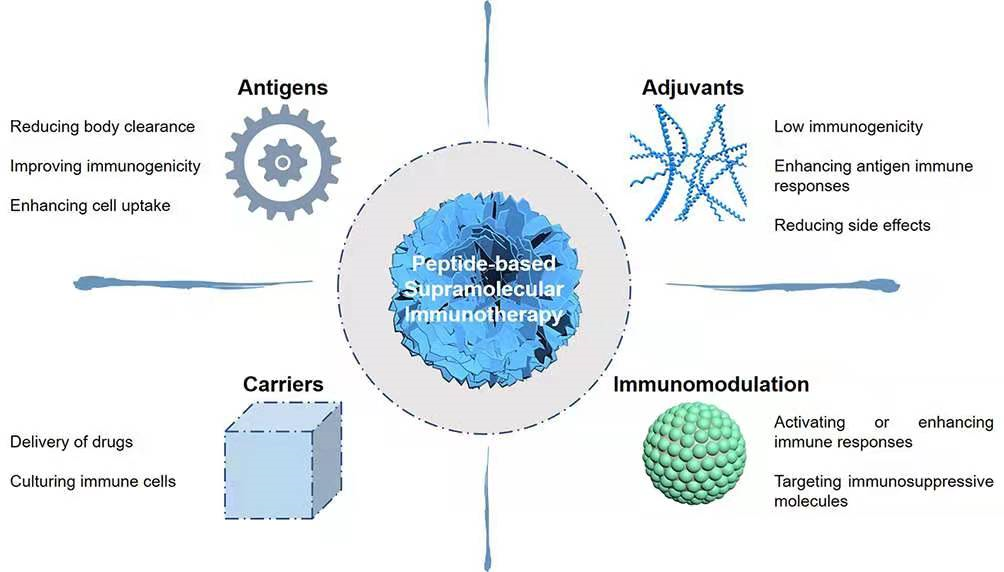
举例而言,如基于肽自组装的超分子肿瘤免疫疗法。单分子的肽在体内有清除率高、结构稳定性差、药物递送效率低、免疫反应不充分和功能单一等问题。超分子肽自组装策略则在设计和构筑功能性材料,应用于肿瘤免疫治疗方面,表现出了灵活性和可控性。通过分子间的多重弱相互作用协同,能够有效增加功能材料的稳定性,显著提高免疫应答效率(见下图)。(2)
又如利用超分子化学的策略,降低化疗药物的毒性,并提高其抗癌疗效。通过超分子自组装纳米材料的介导作用,可以大大改善药物的水溶性,提高药物的生物利用度,实现对载药量和药物释放速度的可控性。为克服化学药物的肿瘤耐药性问题,联合应用其他方法进行治疗,比如分子靶向治疗、免疫治疗、基因治疗等,以产生协同增效作用,有望取得较好的治疗效果。(3)
FIDA技术的主要优势
•直接在缓冲液和血浆中快速高效地表征超分子和其在不同结构之间的转换。
•可得到超低浓度分析物的高质量数据-任何其他技术都难以实现。
•数据可靠,与小角度X射线散射法(SAXS)相一致。
•仅需微量样品。
1.https://www.zhihu.com/question/27133377
2.https://mp.weixin.qq.com/s/HFE5-s29EuQfvQ39JDpfRQ
3.https://mp.weixin.qq.com/s/8XuRxfmr6Ya8W0CWR-zCBw