简介
蛋白质药物是发展迅猛的一类药物化合物。然而,蛋白质药物的发展面临着巨大的挑战——蛋白质具有复杂的分子结构且不十分稳定,同时药物分子、其载体和降解产物有可能会引发免疫原性反应,从而引导致治疗失效、毒副作用甚至是过敏。由于此前的方法不能在天然条件下检测蛋白药物的稳定性,同时又需要大量的样本,故而不能避免上述风险。本应用报告展示了在天然条件下,仅需微量样品,FIDA就能够定量去折叠的人血清蛋白和与荧光素亲和力的损耗。
FIDA是一种新型的毛细管技术,能够在天然条件下定量亲和力和动态地评估蛋白质的稳定性。FIDA利用Taylor色散在压力驱动的流动系统中精确地测定分析物的大小。表观大小的变化形成了精确测量亲和力和蛋白质稳定性的基础。
材料与方法
FIDA 1仪器,266nm和480 nm LIF和LED荧光检测,分别进行去折叠和结合实验(FIDA-Tech ApS)的检测。采用FIDA标准毛细管(i.d.: 75 µm, LT: 100 cm, Leff: 90 cm)。以67 mM,pH为7.4的磷酸盐作为working buffer。去折叠实验:HSA(0.5mg/mL)在0-7M 尿素中作为指示剂。结合实验:在0-4 M尿素溶液中,荧光素为指示剂(10 nM),HSA为分析物(0-500μM);首先将分析物样品填充毛细管,然后注入39 nL指示剂,在400 mbar下,和分析物一起进入检测器。
结果
尿素诱导的HSA去折叠
FIDA的核心技术能够提供精确的流体动力学测量,它被用作探测HSA去折叠后整体变化的方法。HSA内源荧光与低分子量配体结合,荧光素被用来探测蛋白质在不同浓度尿素下的局部结构变化和功能。
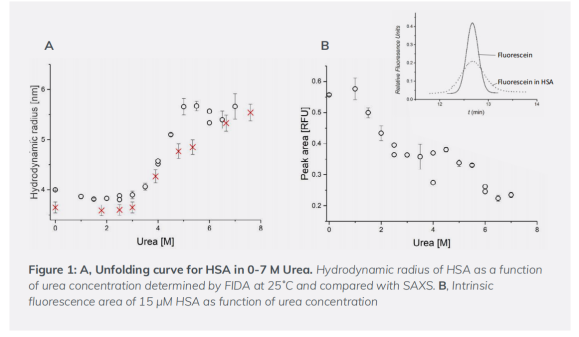
在25℃下,HSA大小的变化(流体动力学半径)与尿素浓度(0-7M)的增加呈函数关系(图1)。当尿素浓度增加到4M时,HSA开始去折叠,HSA的大小由3.5 nm增加至6.2 nm。这与SAXS的结果高度相似。
利用FIDA模型的峰面积探测尿素浓度增加时HSA內源荧光的强度变化。结果表明当尿素浓度达到1.5 M时,HSA内源荧光强度受到影响,证明局部结构的改变发生在整体去折叠之前(图1B),能够同时测量局部和整体的结构变化是FIDA的特有功能。
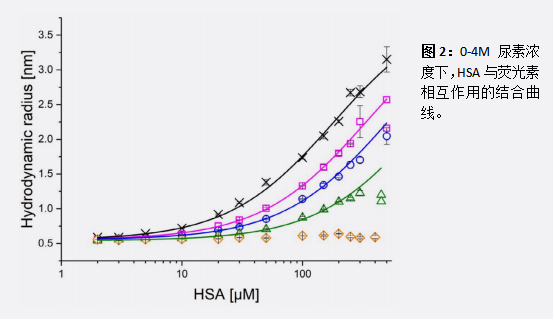
HSA的荧光结合损耗
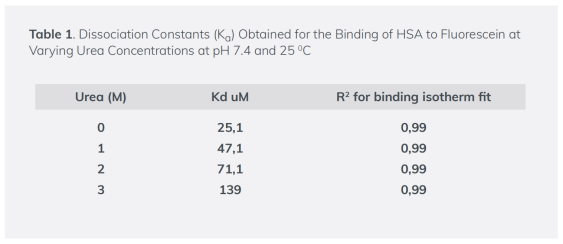
0-4 M尿素浓度下,荧光素与HSA之间相互作用的结合曲线(图2),Kd值如表1所示。复合体的亲和力随着尿素浓度的增加而下降,因此与HSA的去折叠和功能丧失相关。
结论
若想全面了解蛋白质的稳定性和功能,就需要结合不同的技术。FIDA是一种多层次的方法,能够详细描述蛋白质变性和去折叠过程,如尿素诱导的HSA去折叠。只需一台仪器和极少的样本量,通过精确地测量蛋白质的整体水动力半径,结合蛋白质去折叠的局部和整体结构变化,FIDA就能够深入评估蛋白质活性。
