大多数膜蛋白的提取需要用去垢剂(detergent)进行增溶,有效的去垢剂则能提高膜蛋白的溶解度和稳定性。应用Fida 1仪器高通量筛选去垢剂,其主要特点和优势有:
1.快速:筛选12种去垢剂只需3小时(而同等条件下,FSEC法需20小时);
2.信息丰富:同一设备一次实验即可得到多类参数(粒径、峰面积、PDI);
3.操作简单:无需纯化步骤,直接采用粗蛋白液即可进行,自动化上样;
4.节约样品:12种去垢剂的筛选统共用不到1.5 µl膜蛋白样品;
简介
目前有超过50%的药物以及越来越多的药物发现和开发都是针对位于细胞膜上的蛋白质。然而膜蛋白的表达、提取、纯化和维持稳定颇具挑战。由于疏水性,大多数膜蛋白的提取需要用去垢剂(detergent)进行增溶,有效的去垢剂则能够提高膜蛋白的溶解度和稳定性。因此,筛选出最适合的去垢剂是一项重要的工作。在本应用中,Fida 1仪器用于高通量的去垢剂筛选,直接在粗蛋白液中评估GFP标记的膜蛋白的溶解度和多分散性指数(PDI),每次测量仅使用40nL的样品。此外,研究人员还将FIDA去垢剂筛选的方法与FSEC法(分子尺寸排阻荧光色谱法)进行了比较。
FIDA应用报告:高通量快速筛选膜蛋白去垢剂
FIDA检测原理
流体诱导分散分析(FIDA)是一种基于毛细管的微流控方法,利用毛细管中心的流速比毛细管边缘的流速快的原理,在样品区的头部和尾部产生的径向浓度梯度,导致样品发生扩散。不同的扩散横截面(图1.A)决定了生成的曲线的形状(图1.B),结合泰勒分散公式及爱因斯坦方程,以此实现对分子的“第一原理(first principle)”的生物物理学的粒径测量(size,流体力学半径Rh)(图1)。FIDA的size测量广泛适用于生物分子稳定性、相互作用等方面的研究。
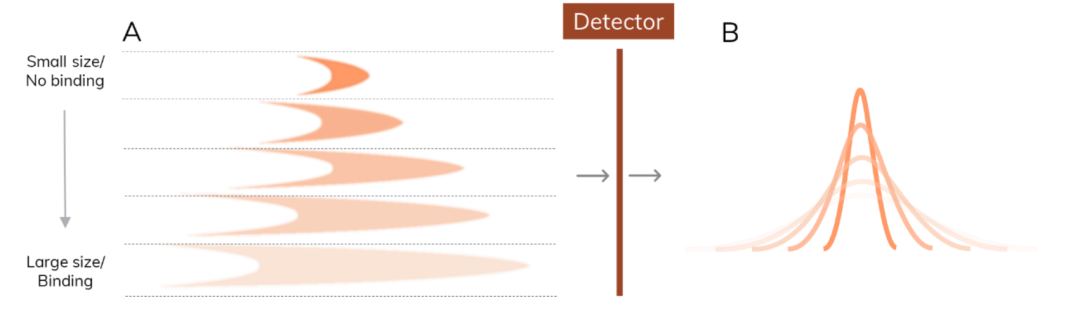

图1:FIDA原理。A. 在毛细管中出现的分散分布。该轮廓的形状取决于带有荧光的分子的大小或其与配体形成的复合物大小;B. 相应的检测器产生的信号峰;C-D.计算扩散系数D和流体力学半径Rh,可得到分子间相互作用亲和力KD值等。
材料与方法
FIDA检测到的荧光信号的强度代表了溶解的荧光团(GFP)的浓度,并与峰面积成正比(图1.B)。因此,FIDA信号峰的面积可以用来评估去垢剂的增溶性能,实验操作简单,无需再次标记,只需要纳升级别的样品即可。在图2所示的实验中, GFP-fused Lactose Permease(GFP-LacY)作为指示剂(Indicator),在12种不同的去垢剂中溶解,以评估去垢剂性能。毛细管用含有特定去垢剂的缓冲液平衡,以去垢剂CHAPS为例,40nL 0.1 mg/ml的GFP-LacY溶解在CHAPS中作为Indicator注入毛细管。
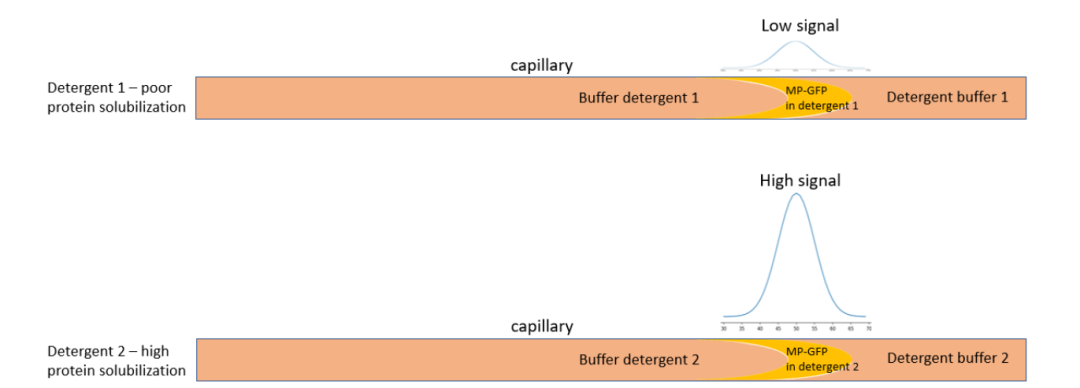
图2:GFP标记膜蛋白去垢剂筛选的实验方法和原始信号示意图。*MP代表膜蛋白。
仪器:Fida1,480nm LED荧光检测。Fidabio标准毛细管(i.d.: 75 µm, LT: 100 cm, Leff: 84 cm)。所有测试样品均装在Fidabio标准玻璃小瓶中进行实验。
指示剂(Indicator):含有可溶解的GFP标记蛋白的粗裂解液。
分析物(Analyte):含有用于溶解目标蛋白质的相应去垢剂的缓冲液。
FIDA实验:将20µL用特定去垢剂溶解的粗膜装入Fidabio玻璃小瓶中(可回收使用)。
共12个样品,每个样品使用不同的去垢剂,装入Fida1系统,在整个测量期间,样品托盘保持在5⁰C。洗涤缓冲液和毛细管中的温度均为25⁰C。GFP-LacY实验采用以下步骤进行:
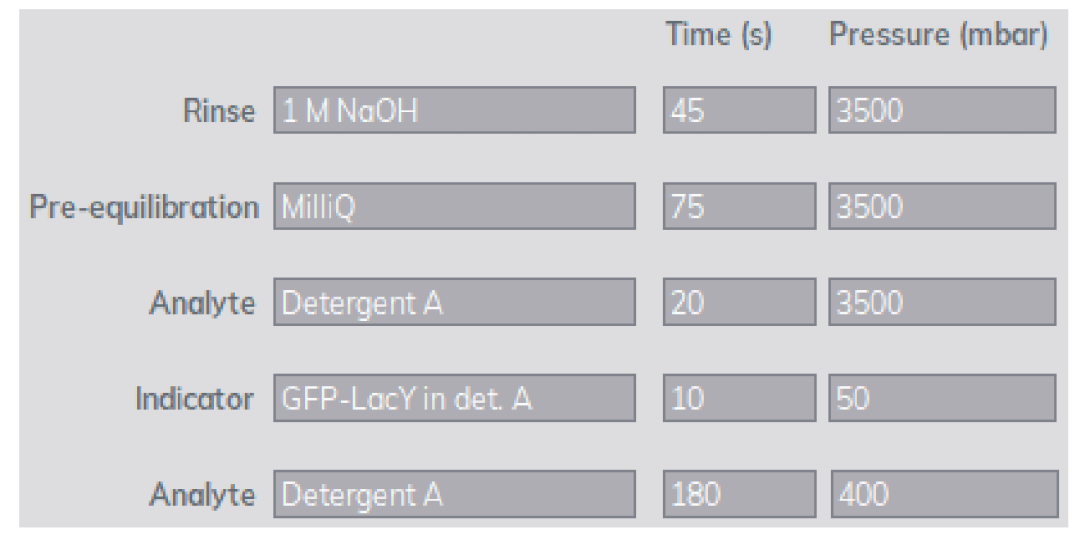
膜蛋白样品制备:将过表达目标蛋白的细胞裂解、离心,不溶性部分在PBS中重悬,等分冷冻。之后,将特定的去垢剂缓冲液加入到粗膜中以溶解目的蛋白。样品4⁰C、100000xg离心45分钟。将含有溶解性膜蛋白的上清液稀释至总蛋白浓度的0.1 mg/ml,用Bradford法测定。稀释后的样品用Fida1仪器和FSEC进行测量。
缓冲液组成:1XPBS,150mM氯化钠+去垢剂;
去垢剂浓度:CHAPS 2%;CHAPSO 2%;CYMAL-6 1%;C12E8 1%;DDM 1%;DM 1%;FC12 1%;LDAO 1%;LMNG 1%;OG 2%;UDM 1%;对照组:无去垢剂。
结果
流体诱导分散分析(FIDA)
GFP-LacY溶解在11种不同的去垢剂和没有任何去垢剂的阴性对照中。图3A显示了所有去垢剂的峰面积的直方图,表明DDM和UDM对GFP-LacY的溶解最有效。用于计算峰值面积的原始信号叠加在图3B中。
Fida1还根据峰的形状计算了样品的多分散性指数(PDI)。多分散样品的PDI值较高,说明该指标存在于不同size的蛋白分子。相反,当PDI低于0.05时,该样品被认为是单分散的。在本实验筛选的去垢剂中,CHAPS、CHAPSO和OG的PDI值较高,其余去垢剂的PDI接近于0,表示为单分散样品(图3C)。这些数据表明,Fida1可以准确地筛选出未纯化样品的最适去垢剂,每次测量仅使用40nL,仅在3小时内就可评估12种不同的去垢剂(n=3)。最重要的是,用于初始加入仪器的20µL样品是可回收的,可以用于下游分析,既节省了样品,又消除了批次间的差异。
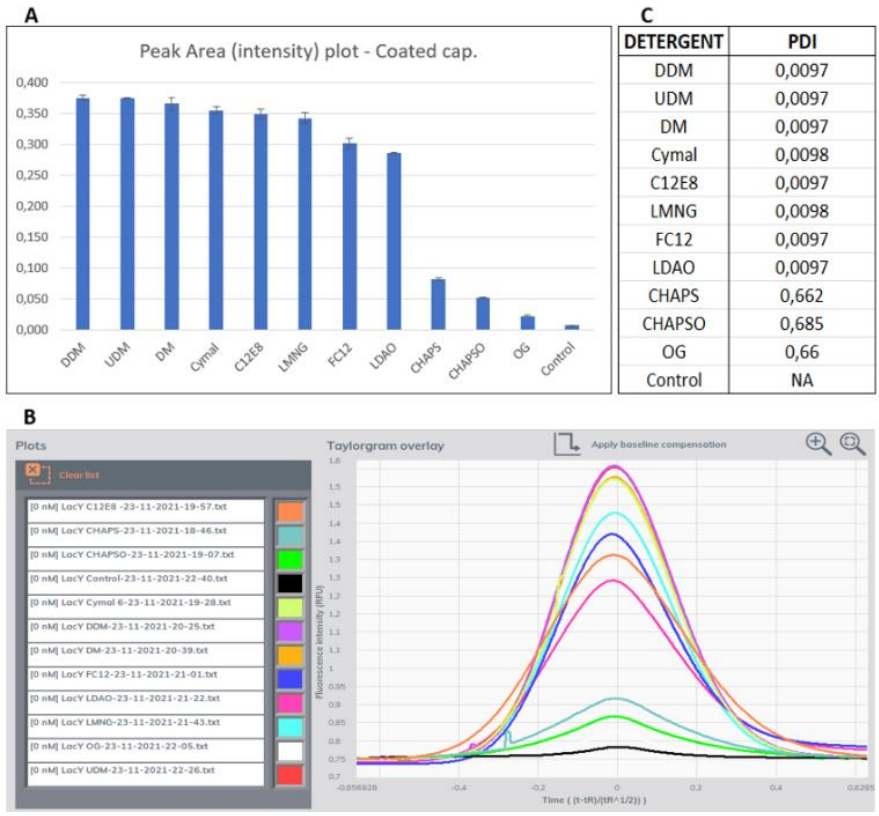
图3:A. FIDA将0.1mg/ml的GFP-LacY溶解在不同去垢剂中进行去垢剂筛选,每种去垢剂溶解的GFP-LacY峰面积直方图;B. 不同去垢剂中GFP-LacY信号的峰值的叠加;C. 不同去垢剂中GFP-LacY的多分散指数(PDI)。
FSEC实验
为了验证FIDA筛选膜蛋白去垢剂的可靠性,实验人员对比了FIDA和FSEC(Fluorescence Size-Exclusion Chromatography,这是去垢剂筛选的标准方法之一)的数据。利用来自FSEC的信号峰用于评估各去垢剂溶解蛋白的水平,以及蛋白质的分散性。图4A展示了12种条件下的重叠的FSEC色谱图。FSEC的结果表明UDM和DDM是溶解GFP-LacY的最佳去垢剂,证实了FIDA得到的结果。
这些数据表明,在筛选膜蛋白去垢剂上,Fida1能够提供与常用的技术几乎一致的结果,同时能够节省10到100倍的样本量,速度更快,同时样品有回收的可能性,如表1所示。图4B基于信号强度比较FSEC和FIDA方法测量的去垢剂溶解力排名,结果大体一致,但在某些去垢剂中表现出细微的差别,产生这种差别的原因可能是FIDA检测一个实验组时重复运行三次,而FSEC只检测一次。总的来说,FIDA和FSEC的针对溶解GPF-LacY蛋白得到的去垢剂排名结果是非常匹配的,因为我们可以看到这两种方法得到的DDM和UDM的溶解强度几乎相同的。

图4:A. 利用FSEC方法对图3中的样品进行去垢剂筛选;B. FIDA与FSEC方法筛选的去垢剂排名比较,第1位是溶解最多GPF-LacY的最佳去垢剂。**DDM和UDM溶解GFPLacY水平几乎相同。
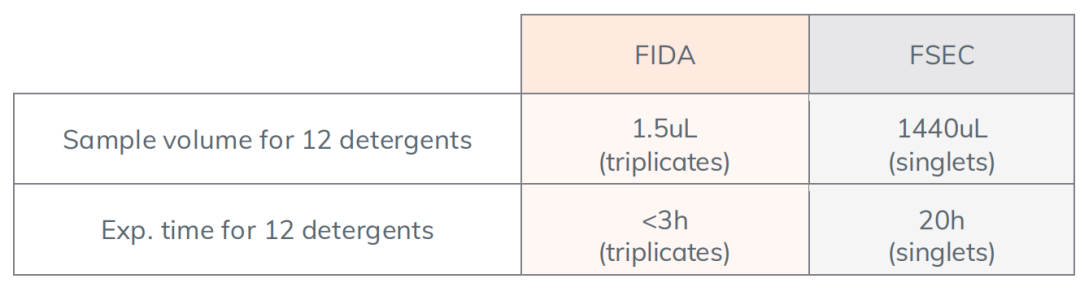
表1:FIDA和FSEC筛选去垢剂的实验比较
结论
这些数据表明,Fida1系统提供了一种新的去垢剂筛选方法,具有显著的优势,用更少的样品、更快地获得多种数据。FIDA一组样品实验仅使用120nL的粗蛋白溶液,浓度为0.1 mg/ml,重复3次,剩余的样品(~19.8µL)可完全回收用于进一步实验。筛选12种去垢剂的实验时间小于3小时,而同样条件下,FSEC方法的实验时间为20小时。Fida1除了能提供和FSEC相同的结果外,Fida1还给出了一个可量化的PDI。总之,这项工作的结果提出了一种新的方法来表征膜蛋白,使用户可以降低成本和时间,并在短时间内分析低水平表达的蛋白质,为克服膜蛋白稳定性的问题提供前期的帮助。
